BLOQUE 4. Energía
4. Calor y temperatura
Anteriormente definimos el trabajo como la cantidad de energía que se transfiere de una forma a otra.
En el ejemplo que analizamos previamente, donde estudiábamos el desplazamiento de un carrito de una montaña rusa, podíamos ver que en las situaciones reales, existen fuerzas de rozamiento que se denominan "no conservativas" que promueven la transformación de la energía tanto potencial como cinética en otro tipo de energía (recordemos que la energía no se crea ni se destruye, sino que se transforma). Pero ¿en qué tipo de energía?
Si analizamos nuevamente nuestro ejemplo teniendo presente esta definición, ¿dónde está la energía que se invirtió en el trabajo para vencer las fuerzas de rozamiento? La respuesta es simple, se transfirió y trasformó en calor, calentándose así las vías y ruedas del carro. Durante la fricción, esta energía trasformada en calor y transferida al medio no puede ser recuperada por el sistema. Es una forma de energía que no puede ser utilizada para realizar trabajo.
¿A qué llamamos calor? Y ¿qué es la temperatura?
Según los científicos contemporáneos, todos los cuerpos existentes están formados por partículas muy pequeñas que interactúan entre sí. Debido a esto presentan lo que se conoce como Energía Interna.
La temperatura es una medida de esta energía interna del cuerpo y denominamos calor a la transferencia de energía que se produce entre cuerpos que se encuentran a diferente temperatura.
Cuando dos cuerpos están en contacto se produce una transferencia desde el cuerpo con mayor energía hacia el de menor energía, hasta que se alcanza el equilibrio térmico, es decir hasta que los cuerpos presenten la misma temperatura.
Analicemos el siguiente texto (y si quieren pueden hacer la prueba, es muy simple):
“El sentido del tacto nos permite distinguir, sin duda alguna
entre un cuerpo caliente y uno frío. Pero esto constituye un
criterio puramente cualitativo, y a veces hasta ambiguo e
insuficiente, para una descripción cuantitativa. Esto se prueba por
una experiencia bien conocida: busquemos tres recipientes que
contengan agua caliente, tibia y fría respectivamente. Si se
introduce una mano en el primer recipiente y la otra en el tercero,
se recibirán dos impresiones de frío y calor correspondientes. Si
se retiran de dichos recipientes y se introducen inmediatamente
en el agua tibia, se obtendrán dos sensaciones contradictorias,
una de cada mano.”
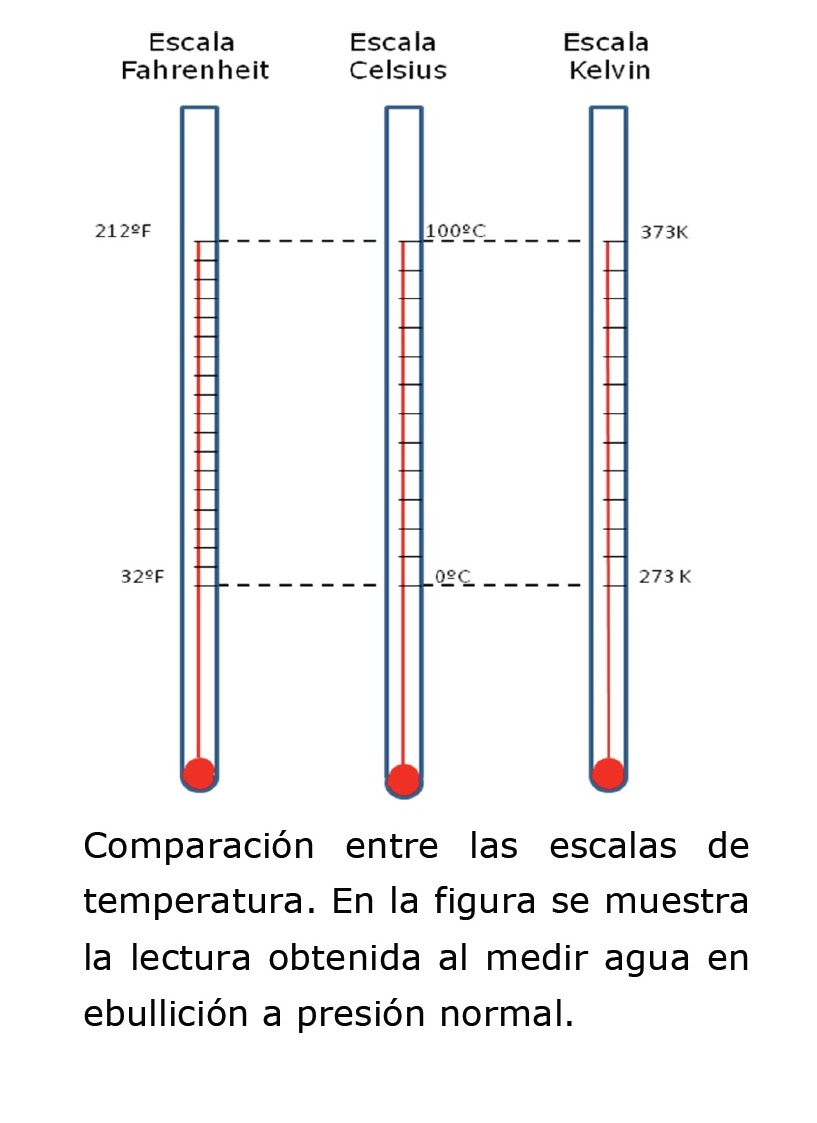
Este ejemplo muestra cómo al introducir las manos en el mismo recipiente, la percepción de frío y cálido no es la misma. Por eso la percepción no es suficiente para evaluar esta cualidad del sistema. Utilizando un termómetro para medir la temperatura de este recipiente podríamos asignarle un valor numérico e independizarnos de la percepción entre lo cálido y lo frío. Existen varias unidades en las que podemos expresar la temperatura. Dentro de las más usadas se encuentran el grado Celsius (ºC), el grado Fahrenheit (ºF) y el Kelvin (K). El sistema Celsius es el utilizado en nuestro país. En este sistema se usa como referencia el punto de fusión del agua para definir el cero de la escala, y el punto de ebullición para los 100 grados, siempre trabajando a presión normal (1 atm). El rango entre estos dos puntos es dividido en 100 partes iguales, por ello también los grados Celsius reciben el nombre de grados centígrados. La escala Fahrenheit se usa mayormente en Estados Unidos, y para los mismos puntos de referencia corresponden 32ºF y 212ºF respectivamente.
En la última escala, denominada escala absoluta, o escala Kelvin, el cero corresponde a -273,15 ºC y la extensión de un Kelvin es igual a la de un grado Celsius. En esta escala, la temperatura de fusión del agua es 273,15 K y la de ebullición es 313,15 K.
| Si les interesa revisar temas sobre medición, unidades e instrumentos de medida pueden verlos en el BLOQUE 1. |